3月2日、「機能性表示食品」制度のガイドライン案が示された。最大のポイントだった「使用可能な研究論文の範囲」は、“軽症者”を使用可とするトクホ並みで決着。業界からは安堵の声が聞かれる。このほか新制度の重要点には企業の「自己判断」を求めるものも多く、事業者や業界の“常識”も試されることになる。消費者庁では4月1日から新制度を施行、「届出」の受け付けを開始する予定。今後の焦点は、安倍首相が「健康食品の機能性表示を解禁します」と明言して、新設された制度が、アベノミクスに寄与するか否かだ。
「軽症者」論文、例外的に認める
制度の前提は、利用する消費者が病人でないこと。病気になる前の「健常人や境界域の人」を対象にしている。
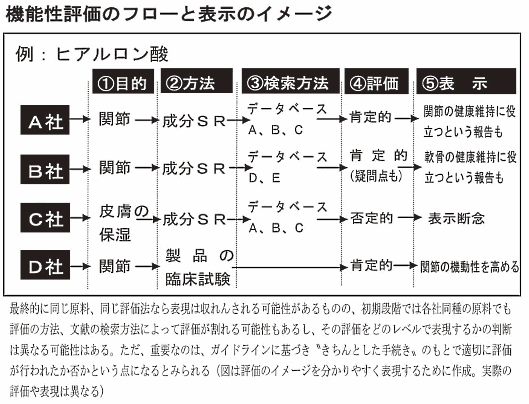
安全性と機能性評価は、機能を発揮する「機能性関与成分」の特定が前提。機能性評価は「製品で行う臨床試験」「製品もしくは成分で行う研究レビュー(システマティックレビュー、以下SR)」のいずれかで行う必要がある。
想定される利用者が「健常人や境界域の人」であることを受け、消費者庁はこれまで機能性評価に使える研究の被験者も疾病者を使ったものは、対象外と公言していた。ただこの方針は検討会には記載がない。また、食品の機能性研究の多くは疾病者が対象。健食等を摂取して、健常者がさらに健康になるデータを取得するのは、技術的にも論理的にも難しいため、制度の実効性に強い懸念の声が上がっていた。
今回のガイドライン案(以下、指針案)でも、一義的に「健常人や境界域の人」を被験者として行われた研究を扱うのが原則。だが、「トクホの試験方法として記載されている範囲」において、「境界域」より病人に近い“軽症者”を含む臨床試験の実施やSRも認めた。ただ軽症者を含む研究論文のデータでSRを行う場合、併せて「健常人や境界域の人」だけのSRも行う必要がある。
トクホ論文の活用範囲広がる
現状、あくまで例外措置だが、“軽症者”の論文を使えることは大きな意味を持つ。一つは、過去に行われてきた研究論文の活用範囲が広がること。特に生活習慣病関係のトクホ論文は使える本数が大幅に増えるとみられる。また、未来においても、健常人だけでは確認できなかったエビデンスを蓄積できる可能性が出てくることだ。
トクホは、その評価において被験者に“軽症者”も認めてきた。国が試験方法を定めているのは、主要な生活習慣病とされる「コレステロール」「中性脂肪」「血圧」「体脂肪」など7分野。これまで、この分野は“軽症者”も含めて企業は試験を行なってきた。だが、新制度が「健常人」「境界域」しか被験者として認めなければ、これまで企業が蓄積してきたトクホ論文を新制度に活用できなくなる可能性があったわけだ。また、“軽症者”とはいえ、疾病者の一部であることに変わりはない。将来的な疾病者の論文活用にも道筋をつけたことになる。
同一性と同等性巡る解釈に決着
「SRの中で『同一性』を判断するのは難しいが、『同等性』は(企業自ら)きちんと確認して説明できることが条件になる」。もう一つ、懸案だったのが、自社製品に使う原料と、SRに使う論文に使用されている原料の「同一性」を巡る問題だ。
例えば、グルコサミン。機能性評価に際し、文献検索すれば広義の「グルコサミン」で論文は得られる。ただ、グルコサミンもその種類はさまざま。米国で使われている多くは「グルコサミン硫酸塩」で、海外から入手できる論文もこれによるものが多い。一方、日本は抽出方法が異なる「グルコサミン塩酸塩」が主流。機能性評価にあたり、原料の違いからくる「同一性」の問題がネックとなる可能性があった。これについて“同等性”を説明できればよいという考えが今回示された。
方法は、企業が自ら調べた論文に掲載されている原料の品種や加工方法などを踏まえ、自己判断で同等といえるのであれば可能というもの。論文と同じ原料サンプルの入手は困難だが、可能なら同等性を実物で評価する必要がある。抽出方法の違いからくる安全面への影響も評価する。
対して「同一性」が求められるのは、届出の場面。すでに届出を行っている製品と内容量や香料、成分の配合割合が異なる製品を新たに届け出る場合、同一であると説明できれば安全性や機能性評価に関わる資料提出の二度手間は省ける。
繰り返された企業の「自己判断」
「企業の自由な発想を削ぐことになるので必要最低限『使用できない表現』のみ示した」「『同等性』の判断は(企業自ら)説明してもらう」――。3月2日、都内で行われた説明会で消費者庁の担当官が繰り返したのは、企業の“自己判断”を求めるものだった。
制度活用に必要な安全性や機能性の評価の手順、届出のルールは実に細かい。
「製品で行う臨床試験」は、研究計画の事前登録や、試験を適切に行うための手順や記録・公表すべき項目を定めたチェックリストである「CONSORT(コンソルト)声明」への準拠が必要。さらに今回、「SR」でも、同様のチェックリストである「PRISMA(プリズマ)声明」に沿って行うことが原則であると示された。
これら指針に基づき届出を行い、その大半を公表する理由は、誰が同じ手法で試験やSRを行っても同じ結果が得られるという“再現性”を担保するため。複数の企業が同じ原料を使って行った機能性評価の結果が仮に違っていたとしても、そのプロセスが明確であればこれを確認し、行政、企業、消費者のいずれもがチェックできる。
判断が、企業に委ねられている部分も多い。安全性評価で調べる食経験は何年食べていれば安全なのか、外国人を対象に行われた論文の結果を日本人に当てはめてもよいという合理性はどう説明すれば良いのか。具体的基準が示されず、判断に迷いが生じそうなものがいくつもある。
説明会に参加したある業界関係者は、「安全性を自ら評価し、機能性もSRなど行い、導き出されたエビデンスからどういった表現が適切と考えるか。企業は評価を行う中で繰り返し自ら判断しなければならない。今後、この制度をいかに活用するかは企業、業界の手に委ねられていると感じた」と感想を話す。新制度では、消費者の視点をいかに捉え適切に表示するか、企業の“常識”が試されることになる。
【「表示」巡る規制環境は?】参考は「ネガティブリスト」のみ
新制度のもと、パッケージや広告表示はどう変わるのか。指針案で示された表示可能な範囲は3つ。血圧や血糖値など明確な指標の変化に対応する「容易に測定可能な体調の指標」への機能、腸内環境への作用など「身体の生理機能、組織機能」に対する機能などだ。これはトクホとほぼ同じ。トクホはこれに加え、条件付きで「疾病リスク低減」への機能も表示できる。
また、「機能性表示食品」では「目」や「関節」など、身体の特定の部位に言及した表現もできる。一方、「診断」「予防」「治療」「処置」など医学的な表現は不可。消費者庁では認められない表現として、「糖尿病の人に」「高血圧の人に」など疾病の治療効果、予防効果を暗示するものなどを挙げた。ただ、使用できる具体的な表現例は示していない。「例示によりそれしか書いてはいけないような狭い考えになるので、ネガティブリストのみ示した」(消費者庁)とする。
米国では、「グルコサミンは軟骨の健康を維持します」など、「~を維持する」「~を調整する」「~を促す」といった表現が可能とされる。企業は先行する米国制度を参考にしつつ、エビデンスと齟齬が生じない範囲でマッチする表現を自ら慎重に検討する必要がある。
◇
パッケージでは、注意表示など義務表示のほかに、「成分」と「最終製品」どちらで得た根拠に基づくかを分かるようにする表示が必要とされた。前者であれば、製品で根拠を得ていないことを明確にする。
また、「臨床試験」と「研究レビュー(SR)」どちらで得た根拠に基づく表示かも分かるようにする。最終製品を使った臨床試験なら「製品にAという成分が含まれるのでBの機能がある」。最終製品を使ったSRなら「製品にAという成分が含まれ、Bの機能があると報告されている」。成分を使ったSRなら「製品にはAが含まれている。AにはBの機能があると報告されている」といった具合だ。
◇
表示監視を巡っては、新制度を前に、厚生労働省が「無承認無許可医薬品の指導取締りについて」(いわゆる46通知)の改正に着手している。これまで、トクホや明らか食品は原則、薬事法(現・医薬品医療機器等法)規制を免れてきた。これに「機能性表示食品」も加わる。つまり、届出を行う限り、原則、薬事法規制を免れるわけだ。
同省監視指導・麻薬対策課は、「(消費者庁が所管する)『機能性表示食品』の取締りにこちらが全面的に出ることはしない。ただ、規制から外すのではなく、(疾病への言及など)あまりに過剰なものは今後も規制対象になりうる」としている。通知改正は、新制度の施行後を予定する。
対する消費者庁は今年1月、食品表示法に基づく「指示」を都道府県や保健所だけでなく、消費者庁も行えるよう定めた内閣府令案を公表した。対象には「機能性表示食品」も含まれる。従来、改善指導にあたる「指示」は都道府県の範疇、国はより重い「勧告・命令」権限で棲み分けていたが、指示権限の保有で軽微な表示違反に対する執行の機動力を高めるとみられる。
また、景品表示法の規制もこれまで同様かかる。これまで“謝れば済む”と理解されてきたが、課徴金制度の導入を控え、表示違反に対する課徴金額は、時として薬事法の広告違反(300万円以下の罰金)より重くなる可能性もある。
厳しい規制が予想されるのが、新制度に乗れない“いわゆる健康食品”。新制度が薬事法の対象外となれば、厚労省や警察当局の監視の目は自然と健食に向かう。景表法の観点からも、根拠を持たないことを自ら公言していると理解され、イメージ広告で訴求するいわゆる健食には厳しい目が向けられそうだ。
※このコンテンツはWebサイト「ネットショップ担当者フォーラム」で公開されている記事のフィードに含まれているものです。
オリジナル記事:「機能性表示食品」制度の4/1施行前に知っておきたいガイドライン案の内容 | 通販新聞ダイジェスト | ネットショップ担当者フォーラム
Copyright (C) IMPRESS CORPORATION, an Impress Group company. All rights reserved.